Osteoporose – sind Prävention und Therapie durch Sport möglich?
Dr. Petra Platen
Zusammenfassung
Schlüsselwörter
Osteoporose
Körperliche Aktivität
Knochengesundheit
Trainingsspezifität
Maximale Knochenmasse
Immobilisation
Muskelmasse
Menopause
Überlastung
Stressfraktur
„Gewichtsbelastende körperliche Aktivitäten sind eine wesentliche Voraussetzung für die Knochengesundheit.“
Trainingswissenschaftliche Aspekte
Spezifität der Trainingswirkung
Trainingsreize sollten an den Skelettstellen wirksam werden, an denen ein Gewinn an Knochenmasse erreicht werden soll, also hauptsächlich an den am stärksten durch Frakturen gefährdeten Bereichen Femur, Wirbelsäule und distaler Unterarm.Höhe der Belastungen
Um knochenwirksame Effekte zu erzielen, müssen die Trainingsreize kontinuierlich gesteigert werden. Vor allem sollten die Trainings-belastungen die üblichen Alltagsbelastungen deutlich übersteigen, wenn ein Gewinn an Knochenmasse erzielt werden soll.Rückbildung der erzielten Effekte
Wenn ein Bewegungsprogramm unter-brochen wird, werden sich die erzielten positiven Effekte am Skelettsystem wieder auf das Ausgangsniveau zurückbilden.Ausgangswerte
Je geringer die Ausgangswerte, um so höher werden die prozentualen Zunahmen an Knochenmasse sein, wenn ein Bewegungsprogramm durchgeführt wird. Je höher die Werte bereits sind, um so geringer sind die Gewinne, die noch erzielt werden können.Individuelles Maximum
Jedes biologische System hat seine genetische Determinierung. Das gilt für die maximal erreichbare körperliche Leistungsfähigkeit im allgemeinen und die Knochenmasse im speziellen. In diesem Zusammenhang stellt sich die Frage, welche Zunahme an Knochenmasse bei jungen Frauen durch ein Fitnessprogramm erreicht werden kann, deren Werte im untersten Bereich des Normalen liegen.
„Es ist unklar, auf welche Weise beim Menschen die stärksten knochenanabolen Effekte erzielt werden.“Intensität, Häufigkeit oder Dauer?
Es ist bis heute unklar, ob beim Menschen durch Steigerung der Intensität, der Häufigkeit oder der Dauer einer Belastung die stärksten knochenanabolen Effekte erzielt werden. Überträgt man jedoch die Ergebnisse tierexperimenteller Studien auf Trainingsregimes beim Menschen, die das Ziel haben, Masse und Festigkeit der Knochen zu vergrößern, so ergeben sich folgende Anforderungen an ein solches Programm [2]:Die Belastungen sollten:
- dynamischer Natur sein,
- mit möglichst hoher Intensität und Frequenz durchgeführt werden und
- möglichst vielseitige Übungen enthalten.
Nicht die Dauer, sondern vielmehr die Häufigkeit der Übungen in Kombination mit deren Intensität scheint die Höhe des knochenanabolen Effektes zu bestimmen. Kurze, intensive Belastungen scheinen eine höhere knochenanabole Wirkung zu haben als langdauernde, wenig intensive. Die simple Verordnung „mehr Bewegung“ zur Osteoporoseprävention genügt nicht (mehr) den heutigen sport-medizinischen Anforderungen, wenngleich in vielen Bereichen noch erheblicher Forschungsbedarf besteht.
Untersuchungen zu den Auswirkungen körperlicher Aktivitäten auf die Knochendichte beim Menschen
Methodische Vorbemerkungen
Die weitaus am häufigsten zur Analyse des Einflusses von körperlicher Belastung auf das Skelettsystem eingesetzte Methode ist die Osteodensitometrie zur Bestimmung des Knochenmineralgehaltes. Aus Gründen der Übersichtlichkeit werden im folgenden unter dem Begriff der „Knochenmasse“ alle anhand unterschiedlicher Messverfahren (wie Computertomographie, Photonenabsorptionsdensitometrie u. a.) und -einheiten gewonnenen Messwerte (Längen-, Flächen- und Volumenwerte) subsummiert.
Peak bone mass
Die maximale Knochenmasse oder auch peak bone mass ist wahrscheinlich weitgehend genetisch determiniert, wird aber durch den Lebensstil mit beeinflusst [3, 4]. Da die Knochenmasse von Kindern an der LWS und am Femur mit dem Aktivitätsniveau ihrer Mütter korreliert, ist der Vorbildfunktion der Eltern eine große Bedeutung bezüglich des Bewegungsverhaltens der Kinder beizu-messen. Insgesamt kann angenommen werden, dass aktivere Kinder mit einer um 5 bis 10% höheren peak bone mass aus der Jugend hervorgehen und somit die „kritische Frakturschwelle“ erst ca. zehn Jahre später erreichen als inaktive Kinder, sofern dieser Vorsprung bis ins Alter erhalten wird.
Aktivität in der Jugend und spätere Knochenmasse
Bei aller Vorsicht, mit der Ergebnisse retrospektiver Studien interpretiert werden sollten, fanden die vorliegenden Untersuchungen [5, 6] positive Korrelationen zwischen der per Fragebogen erhobenen Aktivität in der Jugend bzw. in früheren Jahren und der aktuellen Knochenmasse am Radius bzw. am Calcaneus, ohne jedoch die Aktivitäten genauer zu spezifizieren. Es ist also anzunehmen, dass ein hohes Aktivitätsniveau in der Kindheit und Jugend nicht nur eine hohe peak bone mass zur Folge hat, sondern auch einen überdauernden Effekt für spätere Lebensphasen mit sich bringt.
Immobilisation
Zahlreiche Studien belegen, dass Immobilisation nicht nur zu einer Muskelatrophie, sondern auch zu einer erheblichen Abnahme des Knochenkalksalzgehaltes führt. Dies gilt sowohl für die Ruhigstellung einzelner Skelettabschnitte (z.B. Gipsverband), als auch für längere Bettlägerigkeit und den Aufenthalt in der Schwerelosigkeit (Weltraumflüge) [7, 8, 9, l0]. Der während eines Weltraumfluges beobachtete Knochen-schwund beim Menschen ist in Ausmaß und Dauer dem während horizontaler Bettruhe beobachteten Knochenschwund ähnlich. In der Immobilisation kann es zu einem Verlust an Knochenmasse von 4 bis 5% pro Monat kommen, im Vergleich zur normalen Altersatrophie von 1 bis 2% pro Jahr!
Allgemeines Aktivitätsniveau
Eine Reihe von Studien befasst sich mit dem Einfluss des allgemeinen Aktivitätsniveaus auf die Knochenmasse bzw. den Gesamtkörper-kalziumgehalt [11, 12, 13, 14, 15], wobei vor allem alltägliche Belastungen wie Gehen, Treppensteigen, Garten- und Hausarbeit erfasst wurden. Sportliche Belastungen wie Joggen und Radfahren wurden unter-schiedlich gewichtet. Die Ergebnisse lassen zusammenfassend vermuten, dass sich bereits eine erhöhte körperliche Aktivität im täglichen Leben ohne gezieltes Training einer bestimmten Körperregion positiv auf die Gesamtskelettmasse auswirkt. Der nur geringe oder fehlende Einfluss der alltäglichen Aktivität auf den Radius unterstreicht die Annahme, dass sich körperliche Belastungen vornehmlich auf die direkt betroffenen und belasteten Skelettabschnitte auswirken.
Einfluss der Muskelkraft und Muskelmasse
Die Muskeln übertragen über ihre Ursprünge und Ansätze unmittelbar die Kontraktionskräfte auf die entsprechenden Skelettabschnitte. Daher kann man vermuten, dass Korrelationen zwischen der Muskelkraft bzw. Muskelmasse und der Knochenmasse bestehen. Außerdem kann eine hohe Muskelmasse als Ausdruck einer hohen körperlichen Aktivität gewertet werden, die wiederum per se aufgrund der externen Kräfte (s.o.) knochenstimulierende Wirkungen hat. Zahlreiche Studien zeigen, dass sowohl die allgemeine als auch die spezifische Kraft eine große Bedeutung für die Knochenmasse an einzelnen Skelettabschnitten und am gesamten Skelett haben [16, 17, 18, 19].
Spezifische Trainingseffekte
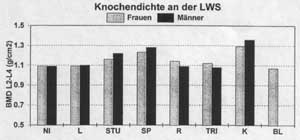
Wenn bereits alltägliche Aktivitäten zum Aufbau bzw. zum Erhalt der Knochenmasse beitragen, welche Effekte lassen sich dann durch intensive, teilweise langjährige Trainingsbelastungen erwarten? Eine große Zahl von Studien wurde an Athleten durchgeführt. Exemplarisch sollen die Ergebnisse einer eigenen Querschnittsuntersuchung ausführlicher dargestellt werden [20]. Wir untersuchten insgesamt 382 Leistungssportler (Alter: 18 bis 30 Jahre) aus verschiedenen Sportartschwerpunkten (Langstreckenlauf, Spielsport, Radsport, Triathlon, Kraftsport und Ballett), unspezifisch trainierte Sportstudierende und untrainierte Kontrollpersonen mit der DEXA-Technik (Osteomobil) an LWS und Femur. Im Bereich der LWS wiesen die Kraft- und Spielsportler sowie die unspezifisch trainierten Sportstudierenden die höchsten Dichtewerte auf (Abb. 2).
„Hohe knochenstimulierende Bedeutung haben vielseitige Belastungen mit großen Kraftwirkungen auf das Skelettsystem.“
Im Bereich der Hüfte fielen bei den Frauen insbesondere die Spielsportlerinnen und bedingt auch die Kraftsportlerinnen auf. Bei den Männern fand sich eine graduelle Abstufung von Spiel- und Kraftsportlern über Sportstudenten, Läufer und Triathleten zu Radfahrern und Nichtsportlern (Abb. 3). Bei aller Vorsicht, mit der Querschnittsvergleiche interpretiert werden sollten, belegen die Ergebnisse dieser und anderer Studien auf der einen Seite die große Bedeutung von kraftbetontem Training und einer großen Muskelmasse für die Knochenmasse an LWS und Femur bei Männern und Frauen. Reines Ausdauertraining (Laufen, Radfahren, Triathlon) hat dagegen im Bereich der LWS keine und im Bereich des Femur nur bei Männern in Laufdisziplinen knochenstimulierende Wirkungen. Die hohen Knochenmassen der Spielsportler und Sportstudierenden machen jedoch deutlich, dass unspezifischen, möglichst vielseitigen Belastungen mit entsprechend hohen Kraftspitzen und vielseitigen Kraftwirkungen auf das Skelettsystem (z.B. Sprünge, Antritte und Stops, Richtungswechsel beim Laufen, Rotationsbewegungen etc.) eine enorme knochenstimulierende Bedeutung zukommt.
Abb. 2: Knochendichtewerte (BMD) an der Lendenwirbelsäule (LWS)
bei Sportlerinnen/Sportlern aus verschiedenen Sportartschwerpunkten
Abb. 3: Knochendichtewerte (BMD) am Femur
bei Sportlerinnen/Sportlern aus verschiedenen Sportartschwerpunkten
Trainingsstudien: Ausdauertraining
Studien zum Einfluss von Ausdauertraining auf die Knochenmasse haben meist intensives Gehtraining, Tanzen/Aerobic oder Joggen bzw. umfangreiches Lauftraining untersucht [21, 22, 23]. Insgesamt zeigte sich, dass moderates Gehen alleine nicht ausreicht, um den alternsbedingten Knochenmasseverlust aufzuhalten. Als Minimalbelastung scheint drei- bis viermaliges intensives Gehtraining bzw. Aerobic/Tanztraining (60 bis 80% der maximalen Herzfrequenz) pro Woche, jeweils 45 bis 60 min, möglichst mit zusätzlicher Gewichtsbelastung, erforderlich zu sein, um knochenstimulierende Effekte bei Untrainierten zu erzielen. Die durch ein derartiges Trainingsprogramm zu erzielenden Knochenmassezunahmen sind jedoch nur gering, reduzieren aber zumindest den zu erwartenden Altersverlust.
Trainingstudien: Krafttraining
Einige spezifische Krafttrainingsstudien wurden sowohl mit jungen Männern als auch mit prä- und postmenopausalen Frauen durchgeführt [24, 25, 26, 27]. Die durch „übliche“ Krafttrainingsprogramme zu erzielenden Knochenmassezunahmen dürften in den meisten Fällen bei maximal etwa 1% pro Jahr liegen und somit die „physiologische“ jährliche Knochenmasseabnahme etwa ausgleichen.
Trainingsstudien: kombinierte Trainingsformen
Einige Interventionsstudien untersuchten zum Teil sehr unterschiedliche Trainingsprogramme, unter anderem auch kombiniertes Ausdauer- und Krafttraining bzw. Ausdauer- und Krafttraining im Vergleich. Bei älteren und sehr alten, untrainierten Menschen konnte bereits durch ein mäßig dosiertes, jedoch regelmäßiges Training (z.B. dreimal pro Woche jew. 30 min Training um einen Stuhl oder dreimal pro Woche jeweils 20 min mildes Gymnastikprogramm) eine leichte Zunahme der Knochenmasse oder zumindest eine Reduktion der alternsbedingten Knochen-masseabnahme und somit ein Erhalt der Knochenmasse erzielt werden [28, 29]. Von großer Bedeutung ist es, dass ein Trainingsprogramm regelmäßig und langfristig durchgeführt wird. Unabhängig davon, ob ein trainingsbedingter Zugewinn an Knochenmasse durch Ausdauer- oder Krafttraining erzielt wurde, geht er bei Reduktion oder Abbruch der körperlichen Belastung wieder verloren.
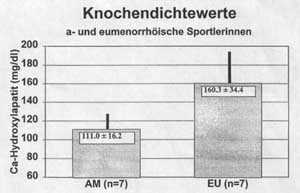
Abb. 4: Knochendichtewerte bei eumenorrhöischen (EU)
im Vergleich zu oligo- und amenorrhöischen (AM) Sportlerinnen
Überlastungsreaktionen
Eine Vielzahl von Untersuchungen an Leistungssportlerinnen konnte nachweisen, dass sportinduzierte Störungen des Menstruationszyklus mit den damit verbundenen niedrigen Sexualsteroidhormon-Konzentrationen, und/oder Essverhaltensstörungen zu pathologisch niedrigen Knochendichtewerten und einer erhöhten Inzidenz von Stressfrakturen führen, trotz der sehr hohen Trainingsbelastungen und der damit verbundenen hohen mechanischen Reizsetzung [30, 31, 32, 33]. In einer eigenen Untersuchung fanden wir dramatisch reduzierte Knochendichtewerte bei a- und oligomenorrhöischen Sportlerinnen (Abb. 4). Auch bei männlichen Langstreckenläufern wurden erniedrigte Knochendichtewerte beschrieben [34]. die möglicherweise auch in Zusammenhang mit reduzierten Sexualhormonkonzentrationen stehen. Stressfrakturen werden bei beiden Geschlechtern unabhängig vom Mineralisationsgrad auch bei rein mechanischer Überbelastung, insbesondere bei ungewohnt hohen Trainingsbelastungen oder ungewohnten Techniken, beobachtet, wobei Störungen des Menstruationszyklus wahrscheinlich zu einer höheren Inzidenz von Stressfrakturen führen [35].
Diese Befunde machen deutlich, dass Trainingsanpassungen des Knochens im Sinne einer Überkompensation nur erzielt werden können, wenn das „endokrine Milieu“ und/oder nahrungsabhängige Parameter nicht pathologisch verändert sind und das Training entsprechend der individuellen Belastbarkeit nach trainingswissenschaftlichen Gesichts-punkten durchgeführt wird.
Körperliche Aktivität in der Menopause
In der Menopause kommt es, bedingt durch die fehlende knochenstimulierende Wirkung der gonadalen Steroide, zu einer deutlichen Zunahme des trabekulären und kortikalen Knochenverlustes [36]. Die vorliegenden Quer- und Längsschnittstudien in dieser Altersgruppe von Frauen liefern widersprüchliche Ergebnisse bezüglich der protektiven Effekte körperlicher Belastungen auf den beschleunigten Knochenverlust. Es gibt jedoch bisher keine Belege dafür, dass körperliche Aktivität alleine den beschleunigten postmenopausalen Knochenmasseverlust aufhalten könnte, eine Reduktion der Verlustrate scheint jedoch möglich. Eine tatsächliche Zunahme an Knochenmasse konnte jedoch durch die Kombination aus Belastung und Hormon-Substitutionstherapie erreicht werden [37].
Körperliche Aktivität und Frakturen
Körperliches Training in der Therapie der Osteoporose
Wesentliche Ziele der Bewegungstherapie in der Behandlung der Osteoporose
- Förderung der Flexibilität und Dehnungsfähigkeit
- Verbesserung der Alltagsmotorik
- Reduktion des Sturzrisikos mit der Gefahr weiterer Frakturen
- Kräftigung insb. der statischen Haltemuskulatur (Aufrichtung des Rumpfes, Verminderung einer kyphotischen Fehlhaltung)
- Entlastung der durch Wirbelfrakturen fehlgestellten und irritierten kleinen Wirbelgelenke
- Langfristige Schmerzreduktion
Nach erfolgter Rehabilitation und Wiedererlangung eines Mindestmaßes an Mobilität und Bewegungssicherheit erscheinen, jeweils unter Berücksichtigung des individuellen Krankheitsbildes, folgende Bewegungsformen sinnvoll.
Sinnvolle Bewegungsformen:
- kraftbetonte Gymnastik sowie dosiertes und gezieltes Krafttraining an Geräten, außerdem
- alle Übungsformen, die Koordination und Flexibilität bei einfacher Dosierbarkeit und kontrollierter Bewegungsausführung schulen.
Sportarten mit erhöhtem Sturz- und Stauchungsrisiko, z.B. Radfahren, Reiten und Turnen, sollten, insbesondere bei fehlender Übung, nicht mehr betrieben werden. Bei genügend Erfahrung in der jeweiligen Sportart kann jedoch das Training in dosierter Form und unter Minimierung des Sturz- und Stauchungsrisikos (z.B. Seniorendreirad, glattes Straßenprofil beim Radfahren etc.) fortgeführt werden.
„Bewegungstherapie hat viele positive Effekte, z.B. der Gewinn an Lebensqualität und ein gewisser Schutz vor weiteren Frakturen.“
Die Bewegungstherapie sollte als regelmäßiges Programm täglich durchgeführt werden. Darüber hinaus bieten sich für das weitere körperliche Training unter anderem örtliche Osteoporose-Sportgruppen an, die Durchführung sportlicher Aktivitäten unter Anleitung geschulter Therapeuten ermöglichen.
Empfehlungen zur Vermeidung von Verletzungs- und Überlastungsrisiken durch Sport
Die folgenden Empfehlungen wurden von der Autorin gemeinsam mit Mitgliedern der Deutschen Arbeitsgemeinschaft Osteoporose erstellt [43].
Sportliche Betätigung und Bewegung sind heute in der allgemeinen Gesundheits-förderung unumstritten. Das Trainingsprogramm sollte auf die individuelle Belastbarkeit eingestellt sein. Wie bei jedem Medikament kommt es auch hier auf die Dosis an. Die inneren Organe, insbesondere das Herz-Kreislaufsystem, haben soviel Reserven, dass sie, sofern sie gesund sind, auch durch noch so extreme Belastungen nicht zum Versagen gebracht werden können. Zu Zwischenfällen kann es bei bestehenden Vorschädigungen (z.B. Koronarsklerose) oder Erkrankungen (z.B. Infekte) kommen. Überlastungen können bei akuter und heftiger Krafteinwirkung (z.B. Sturz) zu Verletzungen der verschiedensten Art führen. Geringgradige, wiederholte Schädigungen (z.B. falsche Hebe-, Trage- oder Übungstechniken) können sich zu Überlastungsschädigungen aufaddieren. Um eine Gefährdung aufgrund einer bestehenden Erkrankung zu vermeiden und um Überlastungen und Verletzungen vorzubeugen, sollten folgende Grundregeln beachtet werden:
Vorsorgeuntersuchung
Vor Aufnahme eines regelmäßigen körperlichen Trainings sollte ins-besondere in den mittleren und älteren Altersgruppen, bei Ungeübten, Untrainierten sowie bei Vorliegen eines erhöhten Risikos für eine organische Erkrankung eine ärztliche Untersuchung einschließlich eines Belastungstests durchgeführt werden.
Auswahl der Sportart und Berücksichtigung der individuellen Fähigkeiten
Es gibt Sportarten mit einem erhöhten Verletzungsrisiko (z.B. alpiner Skisport, Mannschaftsspiele) und solche, bei denen das Risiko, sich zu verletzen, gering ist (z.B. Schwimmen). Dennoch wird das Verletzungsrisiko einer Sportart in erheblichem Maße vom individuellen Können und der richtigen Einschätzung der eigenen Möglichkeiten bestimmt.
Aufwärmen und Abkühlen
Jeder Trainingseinheit und jedem Sportspiel sollte eine Aufwärmphase vorausgehen und eine Abkühlphase folgen. Die Elastizität der Muskulatur und ganz besonders der Sehnen hängt von einer ausreichenden Temperatur ab. Durch das Aufwärmen steigert sich demnach die Geschmeidigkeit. Je nach Sportart sind 10 bis 15 min Aufwärmen einschließlich eines Gymnastikprogramms erforderlich. Das aktive Abkühlen nach einem Trainingsprogramm (Auslaufen, Streching) hält den Stoffwechsel in Gang und beschleunigt den Abtransport von „Schlacken-stoffen“ aus der Muskulatur. Hierdurch werden die Regenerations-prozesse beschleunigt.
Gezielter Trainingsaufbau
Langfristig sollte entsprechend der aktuellen Leistungsfähigkeit und Belastbarkeit ein gezieltes Aufbautraining durchgeführt werden, wobei erst im Laufe des Trainingsprozesses die Belastungsdauer und -intensität erhöht werden. So werden Überlastungen und Verletzungen zu Beginn einer Trainingsphase vermieden.
Kleidung und Ausstattung
Besonderer Wert ist auf eine gute und geeignete Ausstattung zu legen. Neben einer adäquaten Kleidung – sie sollte bequem sein und die Bewegung nicht behindern – verdient gutes Schuhwerk ebenso Beachtung. Es sollte auf die jeweilige Sportart abgestimmt sein (z.B. Wanderschuhe, Laufschuhe, Spezialschuhe für Hallensportarten etc.). Außerdem sollte sich die Auswahl der Sportgeräte (z.B. Alpin- und Langlaufski, Tennisschläger etc.) an der individuellen Leistungsfähigkeit orientieren. Wo es erforderlich ist, ist auf zweckmäßige Schutzkleidung zu achten (z.B. Radhelm, Knie-, Ellbogen- und Handgelenksschoner beim Inline-Skating etc.).
Konkrete Empfehlungen
Grundsätzlich sollte ein der individuellen Leistungsfähigkeit angepasster minimaler Trainingsumfang von 120 bis 150 min pro Woche auf drei oder mehr Trainingseinheiten verteilt werden. Gymnastik- und Aerobic-Programme als eine Kombination von Dehnungs-, Bewegungs- und Kräftigungsübungen für Extremitäten- und Rumpfmuskulatur sind besonders für sportliche Wiedereinsteiger und ältere Menschen empfehlenswert. Bei vormals Untrainierten sind bereits durch geringe Belastungen positive Effekte zu erzielen. Allgemein gilt jedoch, dass die größten Knochenmassezunahmen durch Gewichts- bzw. Kraftbelastungen zu erwarten sind. Besonders günstig wirken sich auch sehr vielseitige Belastungs- und Bewegungsformen, wie sie beispielsweise in Spielsportarten vorkommen, auf die Knochenmasse aus.
Bewegungsprogramme bei manifester Osteoporose zielen primär nicht so sehr in Richtung Knochenaufbau, sondern wollen vor allem die Lebensqualität und die Belastbarkeit im Alltag verbessern und durch die Effekte des körperlichen Trainings einen gewissen Schutz vor weiteren Frakturen erreichen [45, 46].
Literatur
01. Drinkwater BL (1996) Physical activity, fitness, and osteoporosis. ln: BochardC, Shephard RJ, Stephens T (eds) Physical activity, fitness, and health. International Proceedings and consensus statement. Hum Kinetics:724-736
02. Chilibeck PD, Sale DG, Webber CE (1995) Exercise and bone mineral density. Sports Med 19(2):103-122
03. Slemenda CW, Miller JZ, Hui SL, Reister TK, Johnston CC (1991) Role ofphysical activity in the development of skeletal mass in children. J Bone Min Res 6(11):1227-1233
04. Turner JG, Gilchrist NL, Ayling EM, Hassall AJ, Hooke EA, Sadler WA (1992) Factors affecting bone mineral density in high school girls. N Zealand Med J 105(930):95-96
05. Fehily AM, Coles RJ, Evans WD, Elwood PC (1992) Factors affecting bone density in young adults. Am J Clin Nutr 56(3):579-586
06. Kriska AM, Sandler B, Cauley JA, Laporte RE, Hom DL, Pambianco G (1988) The assessment of historical physical activity and its relation to adult bone parameters. Am J Epidemiol 127(5):1053-1063
07. Donaldson CL, Hulley SB, Vogel JM, Hattner RS, Bayers JH, McMillian DE (1970) Effect of prolonged bed rest on bone mineral. Metabolism 19:1071-1084
08. Gazenko OG, Genin NM, Egodorov AD (1981) Major medical results of the Salyut-6/Soyus 185-day space flight. NASA NDB 2747, Proceedings ofthe XXXII Congress of the International Astronautical Federation, Rome, pp 275-293
09. Krolner B, Toft B (1983) Vertebral bone loss: unheeded side effect of therapeutic bed rest. Clin Sci 64:537-540
10. Schneider VS, Huntoon CL, Krauhs JM (1992) Osteoporose beim Weltraumflug. In: Schild HH, Heller M (Hrsg) Osteoporose, Thieme, Stuttgart S.222-228
11. Aloia JF, Askok N, Vaswani MD, Yeh JK, Cohn SH (1988) Premenopausal bone mass is related to physical activity. Arch Intern Med 148:121-123
12. Platen P, deMeirleir K, Louis O, Osteaux M, Hollmann W (1991) Führt Ausdauersport bei Frauen zu Osteoporose? Dt Z Sportmed 42 (Sonderheft):514-523
13. Pocock NA, Eismann JA, Gwinn T, Sambrock PN, Kelly P, Freund I, Yeates MG (1989) Muscle strength, physical fitness, and weight but not age predict femoral neck bone mass. JBone Min Res 4(3):441-448
14. Stillman RJ, Lohmann TG, Slaughter MH, Massey BH (1986) Physical activity and bone mineral content in women aged 30 to 85 years. Med Sci Sports Exerc 18:576-580
15. Zylstra S, Hopkins A, Erk M, Hreshchyshyn MM, Anbar M (1989) Effect of physical activity on lumbar spine and femoral neck bone densities. Int J Sports Med 10(3):181-186
16. Bevier WC, Wiswell RA, Pyka G, Kozak KC, Newhall KM, Marcus R (1989) Relationship of body composition, muscle strength, and aerobic capacity to bone mineral density in older men and women. J Bone Min Res 4:421-432
17. Randerath O, Kvasnicka HM, Wapniarz M, Lehmann R, Haberkamp M, Clausen V, Klein K, Allolio B (1991) Überden Einfluss der Muskelkraft auf die Knochendichte. Osteomobiljournal 5:12-14
18. Snow-Harter C, Marcus R (1991) Exercise, bone mineral density and osteoporosis. In: Exercise and Sports Science Reviews, Vol 19. Wiliam & Wilkins, Baltimore, pp 351-388
19. Snow-Harter C, Whalen R, Myburgh K, Arnaud S, Marcus R (1992) Bone mineral density, muscle strength, and recreational exercise in men. J Bone Min Res 7(11):1291-1296
20. Chae EH, Platen P, Antz R, Kühlmorgen J, Allolio B, Lehmann H, Schuhmann S, Kannenberg J (1994) Knochendichte bei Leistungssportler/innen aus verschiedenen Sportarten im Vergleich zu Sportstudent/innen und untrainierten Kontrollpersonen. ln: Liesen H, Weiß M, Baum M (Hrsg) Regulations- und Repairmechanismen, 33. Deutscher Sportärztekongreß Paderborn. Deutscher Ärzte Verlag, Köln, S 668-671
21. Kirk S, Sharp CF, Elbaum N, Enders DB, Simons SM, Mohler JG, Rude RK (1989) Effect of long-distance running on bone mass in women. J Bone Miner Res 4:515-522
22. Sandler RB, Cauly JA, Hom DL, Sashin D, Kriska AM (1987) The effects of walking on the cross-sectional dimensions of the radius in postmenopausal women.CalcTissue Int; 41:65-9
23. Williams JA, Wagner J, Wasnich R, Heilbrun L (1984) The effect of long-distance running upon apendicular bone mineral content. Med Sci Sports Exerc 16(3):223-227
24. Gleeson GP, Protas EJ, Leblanc AD, Schneider VS, Evans HJ (1990) Effects of weight lifting on bone mineral density in premenopausal women.J Bone Miner Res 5(2):153-158
25. Leichter I, Simkin A, Margulies JY, Bivas A, Steinberg R, Giladi M, Milgrom C (1989) Gain in mass density of bone following strenuous physical activity. J Orthop Res 7(1):86-90
26. Pruitt LA, Jackson D, Bartels RL, Lehnhard HJ (1992) Weight-training effects on bone mineral density in early postmenopausal women. J Bone Miner Res 7(2): 179-185
27. Smidt GL, Lin SY, 0’Dwyer KD, Blanpied PR (1992) The effect of high-intensity trunk execise on bone mineral density of postmenopausal women. Spine 1 17(3):280-285
28. Ringe JD (1988) Osteoporoseprävention durch Gymnastik im höheren Lebensalter. Z Geriatrie 1:86-90
29. Smith EL, Reddan W, Smith PE 1981 Physical activity and calcium modalities for bone mineral increase in aged women. Med Sci Sports Exerc 13(1):60-64
30. Cann CE, Martin MC, Genant HK, Jaffe RB (1984) Decreased spinal mineral content in amenorrheic runners.Jama 251:626-629
31. Drinkwater BL, Nilson K, Chesnut CH, Bremner WJ, Shainholtz S, Southworth MB (1984) Bone mineral content of amenorrheic and eumenorrheic athletes. N Engl J Med 311:277-281
32. Louis 0, de Meirleir K, Keizer HA, Platen P, Hollmann W, Osteaux M (1991) Low vertebral bone density values in young non-elite female run-ners. Int J Sports Med 12:214-217
33. Platen P, deMeirleir K, Louis 0, Osteaux M, HollmannW (1991) Führt Ausdauersport bei Frauen zu Osteoporose? Dt Z Sportmed 42 (Sonderheft):515-523
34. Bilanin JE, Blancherds MS, Russek-Cohen E (1989) Lower vertebral bone density in male long distance runners. Med Sci Sports Exerc 21(1):66-70
35. Margulies JY, Simkin A, Leichter l, Bivas A, Steinberg R, Giladi M, Stein M, Kashtan H, Milgrom C (1986) Effect of intense physical activity on the bone mineral content in the lower limbs of young adults.J Bone Joint Surg 68A:1090-1093
36. Snow-Harter C, Marcus R (1991) Exercise, bone mineral density and osteoporosis. ln: Exercise and Sports Science Reviews, Vol 19. William & Wilkins, Baltimore, pp 351-388
37. Ballard JE, McKeowin BC, Graham HM, ZinkgrafcSA (1990) The effect ofchigh level physical activity (8.5 METs or greater) and estrogen replacement therapy upon bone mass in postmenopausal females, aged 50-68 years. Int J Sports Med 3:208-214
38. Bergmann KE, Wildner M, Caspar W (1994) Epidemiologie der Osteoporose. In: Großklaus R, Stück B, Somogyi A, Stackelberg B von, Pott E (Hrsg) Osteoporose – Prävention in Gegenwart und Zukunft. BGA Schriften. MMV Medizin Verlag München. S 8-12
39. Campbell AJ, Reinken J, Allan BC, Martinez GS (1981) Falls in old age: a study of frequency and related clinical factors. Age and Ageing 10:264-270
40. Semler J (1994) Identifikation von Risikofaktoren. ln: Großklaus R, Stück B, Somogyi A, Stackelberg B von, Pott E (Hrsg) Osteoporose – Prävention in Gegenwart und Zukunft. MMV Verlag, München, S. 25-26
41. Paganini-Hill A, Chao A, Ross RK, Henderson B (1991) Exercise and other factors in the prevention of hip fracture: The leisure world study. Epidemiology 2:16-25
42. Wickam CAC, Walsh K, Cooper C, Parker DJP, Margets BM, Morris J, Bruce SA (1989) Dietary calcium, physical activity, and risk of hip fracture: a prospective study. Br Med J 299:889-892
43. Deutsches Grünes Kreuz (1996) Osteoporose Leitlinien – Die Empfehlungen der Deutschen Arbeitsgemeinschaft Osteoporose (DAGO). Kilian, Marburg
44. Wallwey H (1993) Die Bedeutung der Bewegungstherapie bzw. der körperlichen Aktivität für die Therapie der Osteoporose. Diplomarbeit. Köln
45. DSÄB Stellungnahme, erarbeitet von der Sektion Frauensport, federführend: Platen P, Damm F, Marx K (1995) Sport und Osteoporose. Dt Z Sportmed 46(5):267-268
46. Platen P (1995) Mobilität, Fitness und Osteoporoseentstehung. Dt Z Sportmed 46 (Sonder-heft 1):48-56
Artikel aus Bundesgesundheitsblatt 1·2001
Dr. Petra Platen
Institut für Kreislaufforschung und Sportmedizin,
Deutsche Sporthochschule Köln
Carl Diem-Weg 6
50933 Köln
eMail: platen@hrz.dshs-koeln.de